UTILIDADES DE LOS ALCOHOLES ESTERES Y ÉTERES
TRABAJO PRESENTADO:
WILSON FERLEY SANCHEZ FLOREZ
GRADO:11-3T
ALCOHOL
PROPIEDADES FISICAS:
Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol.
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
Punto de Ebullición: Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones.


Propiedades químicas:
Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo

USOS
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica
agentes de flotación para minerales, esencias
de frutas, perfumes y colorantes.
El isobutanol , un disolvente para revestimientos de superficie y
adhesivos, se emplea en lacas, decapantes de pinturas, perfumes,
productos de limpieza y líquidos hidráulicos. El terc-butanol se
utiliza para la eliminación del agua de los productos, como disolvente en la fabricación de fármacos, perfumes y aromas, y como
producto químico intermedio. También es un ingrediente de
productos industriales de alcohol, un desnaturalizante de alcoholes y un cebador de octano en gasolinas. Los alcoholes amílicos
actúan como espumígenos en la flotación de minerales. Muchos
alcoholes, entre ellos el alcohol metilamílico, 2-etilbutanol, 2-etilhexanol,
ciclohexanol, 2-octanol y metilciclohexanol, se utilizan en la fabricación
de lacas. Además de sus numerosas aplicaciones como disolventes, el ciclohexanol y el metilciclohexanol son también útiles
en la industria textil. El ciclohexanol se utiliza en el acabado
de tejidos, el procesado del cuero y como homogeneizador de
jabones y emulsiones detergentes sintéticas. El metilciclohexanol
es un componente de productos quitamanchas a base de jabón y
un agente de mezcla en jabones y detergentes para tejidos especiales. El alcohol bencílico se utiliza en la preparación de perfumes
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánicaLos alcoholes se utilizan como productos químicos intermedios y
disolventes en las industrias de textiles, colorantes, productos
químicos, detergentes, perfumes, alimentos, bebidas, cosméticos,
pinturas y barnices. Algunos compuestos se utilizan también en la
desnaturalización del alcohol, en productos de limpieza, aceites
y tintas de secado rápido, anticongelantes, agentes espumígenos
y en la flotación de minerales.
Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol.
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
Punto de Ebullición: Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones.


Propiedades químicas:
Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo

USOS
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica
agentes de flotación para minerales, esencias
de frutas, perfumes y colorantes.
El isobutanol , un disolvente para revestimientos de superficie y
adhesivos, se emplea en lacas, decapantes de pinturas, perfumes,
productos de limpieza y líquidos hidráulicos. El terc-butanol se
utiliza para la eliminación del agua de los productos, como disolvente en la fabricación de fármacos, perfumes y aromas, y como
producto químico intermedio. También es un ingrediente de
productos industriales de alcohol, un desnaturalizante de alcoholes y un cebador de octano en gasolinas. Los alcoholes amílicos
actúan como espumígenos en la flotación de minerales. Muchos
alcoholes, entre ellos el alcohol metilamílico, 2-etilbutanol, 2-etilhexanol,
ciclohexanol, 2-octanol y metilciclohexanol, se utilizan en la fabricación
de lacas. Además de sus numerosas aplicaciones como disolventes, el ciclohexanol y el metilciclohexanol son también útiles
en la industria textil. El ciclohexanol se utiliza en el acabado
de tejidos, el procesado del cuero y como homogeneizador de
jabones y emulsiones detergentes sintéticas. El metilciclohexanol
es un componente de productos quitamanchas a base de jabón y
un agente de mezcla en jabones y detergentes para tejidos especiales. El alcohol bencílico se utiliza en la preparación de perfumes
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánicaLos alcoholes se utilizan como productos químicos intermedios y
disolventes en las industrias de textiles, colorantes, productos
químicos, detergentes, perfumes, alimentos, bebidas, cosméticos,
pinturas y barnices. Algunos compuestos se utilizan también en la
desnaturalización del alcohol, en productos de limpieza, aceites
y tintas de secado rápido, anticongelantes, agentes espumígenos
y en la flotación de minerales.


BENEFICIOS Y RIESGOS
El alcohol metílico tiene propiedades tóxicas que pueden
hacerse evidentes tanto por exposición aguda como crónica. Los
alcohólicos que ingieren este líquido o los trabajadores que
inhalan sus vapores pueden sufrir lesiones. En experimentos con
animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal.
En casos de intoxicación grave, generalmente por ingestión, el
alcohol metílico actúa de forma específica en el nervio óptico
La acción tóxica del alcohol metílico se atribuye a oxidación
metabólica en ácido fórmico o formaldehído, producto éste que
tiene un efecto nocivo específico en el sistema nervioso, y posiblemente a acidosis grave. Estos procesos de oxidación pueden se
inhibidos por el alcohol etílico
NOMBRE Y ESCTRUTURA DE LOS COMPONENTES MAS REPRESENTATIVOS
| La Simetría: Al igual que los tipos de enlace, la conformación estructural tiene gran influencia sobre las propiedades físicas. En una cadena recta hay mayor atracción intermolecular, la ramificación aumenta la distancia entre cadenas adyacentes disminuyendo la atracción intermolecular entre las moléculas vecinas. A medida que aumentan las ramificaciones la forma de la molécula tiende a aproximarse a la de una esfera, con lo que disminuye su superficie, lo que se traduce en un debilitamiento de las fuerzas intermoleculares que pueden ser superadas a temperaturas más bajas.(ver tabla) | |||||||||||||||||||||||||||||||||||||||
En el caso del punto de fusión la variación no siempre es regular, debido a que en un cristal las fuerzas intermoleculares no sólo dependen del tamaño de las moléculas sino también de su acomodo más o menos perfecto en el retículo cristalino, pero generalmente a menor simetría es menor el punto de fusión.La disposición espacial de los átomos en las moléculas modifica también las propiedades físicas de compuestos semejantes. (ver tabla)
| |||||||||||||||||||||||||||||||||||||||
| Efecto inductivo: Se presenta en el estado normal de las moléculas con enlaces covalentes simples y permite que el par electrónico se desplace ligeramente cuando en la molécula existe un átomo que ejerza sobre el par electrónico una atracción mayor o menor que el resto de los átomos. El efecto inductivo puede ejercerlo un sustituyente, el cual va a polarizar de manera permanente un enlace. Esta acción se transmite a través de la cadena carbonada. |
| ||||||||||||||||||||||||||||||||||||||
El efecto inductivo se presenta cuando se unen a un átomo de carbono, átomos o grupos atómicos aceptores de electrones (agentes electrofílicos); la excepción más importante la constituyen los grupos alquilo (-R) que son dadores de electrones (agentes neutrofílicos). Si un átomo o grupo de átomos es más electronegativo que el átomo de hidrógeno, se dice que posee un efecto inductivo negativo (-I), mientras que si es menos electronegativo que el átomo de hidrógeno, se dice que tiene efecto inductivo positivo (+I). Este efecto es el responsable del aumento o disminución de la acidez o alcalinidad (basicidad) de algunos compuestos. | |||||||||||||||||||||||||||||||||||||||
La constante de equilibrio (ionización o acidez) para la reacción anterior, esta dada por la siguiente expresión:
Mientras mayor es la magnitud de Ka, indica mayor fuerza del ácido.
| Acidez: La propiedad química característica de los ácidos carboxílicos, es la acidez. Según Bronsted – Lowry, son ácidos porque cada grupo carboxilo tiene la capacidad de donar un protón en un intercambio ácido-base, debido al grupo OH presente. En una solución acuosa de un ácido carboxílico cualquiera, el agua actúa como aceptor de protones, es decir como una base, estableciéndose un equilibrio entre el ácido orgánico, agua, ión carboxilato y el ión hidronio. | ||||||||||||||||||||||||||||||||||||||
En aquellos compuestos que presentan sustituyentes, como en el ejemplo de la tabla donde el sustituyente es el cloro (Cl), este da lugar a que haya un desplazamiento de la densidad electrónica hacia sus vecinos, con la consiguiente disminución de densidad electrónica en el grupo carboxilo -COOH. Esta es la causa de que el átomo de hidrógeno del grupo –COOH quede más suelto y, por esta razón, la fuerza de atracción que ejerce el disolvente polar (agua) sobre este átomo de hidrógeno origina una mayor disociación. (ver tabla)
Si se aleja el sustituyente inductivo del grupo –COOH, el efecto inductivo será más débil a medida que el sustituyente se aleja del grupo –COOH inducido. (ver tabla)
| |||||||||||||||||||||||||||||||||||||||
Este efecto está íntimamente relacionado con la electronegatividad de los elementos, por ello el a -fluor –etanoico es más ácido que el a - yodo etanoico.(ver tabla)
| |||||||||||||||||||||||||||||||||||||||
| Basicidad: El efecto inductivo también influye en la alcalinidad. Según Bronsted –Lowry, una base es un aceptor de protones. En una solución acuosa de amoniaco, el agua actúa como un dador de protones (ácido), los protones son aceptados por el amoniaco que actúa como una base, estableciéndose un equilibrio entre amoniaco, agua ión amonio e ión oxhidrilo. |
La constante de basicidad se calcula aplicando la siguiente fórmula:
| ||||||||||||||||||||||||||||||||||||||
| Según la definición de Lewis, una base es una sustancia donante de pares electrónicos y un ácido un aceptor de pares electrónicos. El amoniaco, las aminas, el agua y el ión oxhidrilo son bases, pues tienen pares electrónicos disponibles que pueden compartir, mientras que el protón y el ión hidronio son ácidos, por su deficiencia en electrones.
ETERES
PROPIEDADES DE LOS ETERES
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.1
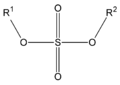
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso éste reacciona con cloruro férrico produciendo un hidroxamato de intenso color rojo-violeta.Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados:
En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes.
En la formación de ésteres, cada radical OH (grupo hidroxilo) del radical del alcohol se sustituye por la cadena -COO del ácido graso. El H sobrante del grupo carboxilo, se combina con el OH sustituido, formando agua.
En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico o inorgánico.
Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación:
Un éster cíclico es una lactona.
Etanoato de metilo.
La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:
· La otra mitad, de metilo, proviene del alcohol metílico (metanol).
En el dibujo de la derecha se observa la parte que procede del ácido (en rojo; etanoato) y la parte que procede del alcohol (en azul, de etilo).
Luego el nombre general de un éster de ácido carboxílico será "alcanoato de alquilo" donde:
· alcan-= raíz de la cadena carbonada principal (si es un alcano), que se nombra a partir del número de átomos de carbono. Ej.:Propan- significa cadena de 3 átomos de carbono unidos por enlaces sencillos.
· oato = sufijo que indica que es derivado de un ácido carboxílico. Ej: propanoato: CH3-CH2-CO- significa "derivado del ácido propanoico".
· de alquilo: Indica el alcohol de procedencia. Grupo general:...
Por ejemplo: -O-CH2-CH3 es "de etilo" En conjunto CH3-CH2-CO-O-CH2-CH3 se nombra propanoato de etilo.
Propiedades físicas
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
· salicilato de metilo (aceite de siempreverde o menta): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:

Reacción de saponificación o hidrólisis.
Propiedades químicas En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. Lasaponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación. Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de alcohol.2 La reacción es de amplio espectro y se ha utilizado para reducir diversos ésteres. Las lactonas producen dioles. Existen diversos agentes reductores alternativos al hidruro de litio y aluminio como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3 reflujado con THF.3 El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.4 El mecanismo probablemente se debe a la formación de un alqueno intermediario.  El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o elalcóxidocorrespondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como lacondensación de Claisen , la Condensación de Dieckmann y la síntesis malónica. Muchos El hidrógeno α de muchos ésteres puede ser sustraído con una base no nucleofílica o elalcóxidocorrespondiente al éster. El carbanión generado puede unirse a diversos sustratos en diversas reacciones de condensación, tales como lacondensación de Claisen , la Condensación de Dieckmann y la síntesis malónica. Muchosmétodos de síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary. Existen reacciones de condensación en las que se utiliza un reductor que aporte electrones para formar el enlace C-C entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau. 
USOS DE LOS ETERES
Medio para extractar para concentrar ácido acético y otros ácidos.· Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos. · Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides). · Combustible inicial de motores Diésel. · Fuertes pegamentos · Antinflamatorio abdominal para después del parto, exclusivamente uso externo.
BENEFICIOS Y RIESGOS PARA LA SALUD
Los éteres de polibromodifenilos (PBDEs) son sustancias químicas que retardan el fuego y que se agregan a productos de plástico y de espumas para hacer más difícil que se incendien. Hay diferentes tipos de PBDEs; algunos solamente tienen unos pocos átomos de bromo, mientras que otros tienen hasta diez átomos de bromo unidos a la molécula central. Los PBDEs existen en forma de mezclas de compuestos químicos similares. Debido a que sólo se mezclan con los plásticos y espumas en vez de unirse a ellos, pueden escapar de los productos que los contienen y entrar al medio ambiente.•Algunos PBDEs pueden acumularse en peces, aunque generalmente en bajas concentraciones. Regrese al comienzo de la página. ¿Cómo puede ocurrir la exposición a los PBDEs? •Las concentraciones de PBDEs en la sangre, leche materna y tejido graso de seres humanos indican que la mayoría de la gente está expuesta a concentraciones bajas de PBDEs. •Usted puede estar expuesto a los PBDEs a través del consumo de alimentos o inhalación de aire contaminados con PBDEs. •Los trabajadores que manufacturan PBDEs o productos que contienen PBDEs pueden estar expuestos a niveles más altos que lo normal. •También puede ocurrir exposición ocupacional en personas que trabajan en espacios cerrados en donde se reparan o reciclan productos que contienen PBDEs. Regrese al comienzo de la página. ¿Cómo pueden afectar mi salud los PBDEs? No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo. Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales. ¿Qué posibilidades hay de que los PBDEs produzcan cáncer? No sabemos si los PBDEs pueden producir cáncer en seres humanos. Las ratas y ratones que comieron de por vida alimentos con éter de decabromobifenilo (un tipo de PBDE) desarrollaron tumores en el hígado. Basado en esta evidencia, la EPA ha clasificado al éter de decabromobifenilo como posiblemente carcinogénico en seres humanos. La EPA ha determinado que los PBDEs con menos átomos de bromo que el éter de decabromobifenilo no son clasificables en cuanto a carcinogenicidad en seres humanos debido a la falta de estudios de cáncer en seres humanos y en animales. ¿Cómo pueden los PBDEs afectar a los niños? Los niños generalmente están expuestos a los PBDEs de la misma manera que los adultos, principalmente al comer alimentos contaminados. Debido a que los PBDEs se disuelven fácilmente en la grasa, pueden acumularse en la leche materna y puede ser transferidos a bebés que lactan.La exposición a los PBDEs en el útero y a través de la leche materna ha producido alteraciones de la tiroides y del comportamiento en animales recién nacidos, pero no ha producido defectos de nacimiento. No se sabe si los PBDEs pueden producir defectos de nacimiento en seres humanos.
NOMBRE Y ESTRUCTURA DE LOS COMPONENTES MAS REPRESENTATIVOS DE LOS ETERES
Dietil éterArtículo principal: Éter etílico.El término "utéro" se utiliza también para referirse solamente al éter llamado "dietiléter" (según la IUPAC en sus recomendaciones de 1993 "etoxietano"), de fórmula química CH3CH2OCH2CH3. El alquimista Raymundus Lullis lo aisló y subsecuentemente descubrió en1275. Fue sintetizado por primera vez por Valerius Cordus en 1540. Fue utilizado por primera vez como anestésico. ETERES CORONA Estos compuestos tienen orientados los átomos de oxígeno hacia el interior del ciclo, y las cadenas alquílicas hacia el exterior del ciclo, pudiendo complejar cationes en su interior. La importancia de este hecho es que estos compuestos son capaces de solubilizar sales insolubles en disolventes apolares. Dependiendo del tamaño y denticidad de la corona, ésta puede tener mayor o menor afinidad por un determinado catión. Por ejemplo, 12-corona-4 tiene una gran afinidad por el catión litio, 15-corona-5 por el catión sodio y el 18-corona-6 por el catión potasio.  Síntesis de éteres La síntesis de éteres de Williamson es la síntesis de éteres más fiable y versátil. Este método implica un ataque SN2 de un ion alcóxido a un haluro de alquilo primario no impedido o tosialato. Los haluros de alquilo secundarios y los tosialatos se utilizan ocasionalmente en la síntesis de Williamson, pero hay competencia en las reacciones de eliminación, por lo que los rendimientos con frecuencia son bajos.  Síntesis de éteres mediante aloximercuriación-desmercuriación. En el proceso de aloximercuriación-desmercuriación se añade una molécula de un alcohol a un doble enlace de un alqueno. Se obtiene un éter tal como se muestra a continuación:  Síntesis industrial: deshidratación bimolecular de alcoholes. Reacción de Arens-van Dorp   
Propiedades fisicas y quimicas de los Esteres
PROPIEDADES FISICAS: Al tratarse de compuestos moleculares (líquidos volátiles o sólidos) sus propiedades físicas más representativas son: Aislantes eléctricos en fusión y en disolución. Bajo temperatura de fusión y ebullición que crece con la masa molar. Las propiedades físicas y químicas de los ésteres de bajo peso molecular corresponden, en general, a una combinación de las propiedades de los dos grupos. Al aumentar el peso molecular, la parte de hidrocarburo de la molécula tiene un efecto preponderante sobre las funciones oxigenadas, razón por la cual los ésteres superiores son ceras sólidas, blandas e insolubles en agua. Según la longitud de la cadena hidrocarbonada serán más o menos solubles en agua y más o menos solubles en disolventes orgánicos (hexano, éter, benceno, acetona…) A causa del número extraordinariamente elevado de ácidos y alcoholes que pueden utilitzarse en la reacción de esterificación, se han preparado y estudiado miles de ésteres, desde el más sencillo (HCOOCH3, formiato de metilo), hasta los compuestos de peso molecular más elevado que contienen 30 o más átomos de carbono en ambas partes de la molécula. PROPIEDADES QUIMICAS: En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas. Los Esteres son compuestos que se forman por la unión de ácidos con alcoholes, generando agua como subproducto. Como se ve en el ejemplo, el hidroxilo del ácido se combina con el hidrógeno del radical hidroxilo del alcohol. Nomenclatura: Se nombran como si fuera una sal, con la terminación “ato” luego del nombre del ácido seguido por el nombre del radical alcohólico con el que reacciona dicho ácido. Los ésteres se pueden clasificar en dos tipos: Ésteres inorgánicos: Son los que derivan de un alcohol y de un ácido inorgánico. Por ejemplo: Ésteres orgánicos: Son los que tienen un alcohol y un ácido orgánico. Como ejemplo basta ver el etanoato de propilo expuesto arriba. Otro criterio o forma de clasificarlos es según el tipo de ácido orgánico que se uso en su formación. Es decir, si se trata de un ácido alifático o aromático. Aromáticos son los derivados de los anillos bencénicos como se ha explicado anteriormente. Para los alifáticos hacemos alusión nuevamente al etanoato de propilo anteriormente expuesto. Al proceso de formación de un éster a partir de un ácido y un alcohol se lo denomina esterificación. Pero al proceso inverso, o sea, a la hidrólisis del éster para regenerar nuevamente el ácido y el alcohol se lo nombra saponificación. Este término como veremos es también usado para explicar la obtención de jabones a partir de las grasas. Obtención de Ésteres: Veremos algunos de los métodos más usados. Los ésteres se preparan combinando un ácido orgánico con un alcohol. Se utiliza ácido sulfúrico como agente deshidratante. Esto sirve para ir eliminando el agua que se forma y de esta manera hacer que la reacción tienda su equilibrio hacia la derecha, es decir, hacia la formación del éster. Combinando anhídridos con alcoholes.
Usos de los Esteres
Medio para extractar para concentrar ácido acético y otros ácidos. Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos. Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides). Combustible inicial de motores Diésel. Fuertes pegamentos. Antinflamatorio abdominal para después del parto, exclusivamente uso externo. Los ésteres son empleados en muchos y variados campos del comercio y de la industria, como los siguientes: Disolventes: Los ésteres de bajo peso molecular son líquidos y se acostumbran a utilizar como disolventes, especialmente los acetatos de los alcoholes metílico, etílico y butílico. Plastificantes: El acetatopropionato de celulosa y el acetatobutirato de celulosa han conseguido gran importancia como materiales termoplásticos. El nitrato de celulosa con un contenido de 10,5-11% de nitrógeno se llama piroxilina y con alcohol y alcanfor (plastificante) forma el celuloide. El algodón dinamita es nitrato de celulosa con el 12,5-13,5% de nitrógeno. La cordita y la balistita se fabrican a partir de éste, que se plastifica con trinitrato de glicerina (nitroglicerina). Los sulfatos de dimetilo y dietilo (ésteres del ácido sulfúrico) son excelentes agentes de alcoholización de moléculas orgánicas que contienen átomos de hidrógeno lébiles, como por ejemplo, el midón y la celulosa. Aromas artificiales: Muchos de los ésteres de bajo peso molecular tienen olores característicos a fruta: plátano (acetado de isoamilo), ron (propionato de isobutilo) y piña (butirato de butilo). Estos ésteres se utilizan en la fabricación de aromas y perfumes sintéticos. Aditivos Alimentarios: Estos mismos ésteres de bajo peso molecular que tienen olores característicos a fruta se utilizan como aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado. Productos Farmacéuticos: Productos de uso tan frecuente como los analgésicos se fabrican con ésteres. Polímeros Diversos: Los ésteres de los ácidos no saturados, por ejemplo, del ácido acrílico o metacrílico, son inestables y se polimerizan rápidamente, produciendo resina; así, el metacrilato de metilo (lucita o plexiglás). De manera análoga los ésteres de los alcoholes no saturados son inestables y reaccionan fácilmente con ellos mismos; así, el acetado de vinilo se polimeriza dando acetato de polivinilo. Las resinas de poliéster, conocidas como gliptales, resultan de la poliesterificación de la glicerina con anhídrido ftálico; el proceso puede controlarse de manera que se produzca una resina fusible o infusible. Cuando la poliesterificación se realiza en presencia de un ácido no saturado de cadena larga del tipo de los aceites secantes, la polimerización de éste por oxidación se superpone a la poliesterificación y se producen los esmaltes sintéticos, duros y resistentes a la intemperie, que son muy adecuados por el acabado de los automóviles. La poliesterificación del etilenglicol con el ácido tereftálico produce fibra de poliéster. Si se da forma de láminas a este material, constituye una excelente película fotográfica. Repelentes de insectos: Todos los repelentes de insectos que podemos encontrar en el mercado contienen ésteres.
Beneficios y riesgos de los Esteres para la
salud
Qué son los PBDEs? Los éteres de polibromodifenilos (PBDEs) son sustancias químicas que retardan el fuego y que se agregan a productos de plástico y de espumas para hacer más difícil que se incendien. Hay diferentes tipos de PBDEs; algunos solamente tienen unos pocos átomos de bromo, mientras que otros tienen hasta diez átomos de bromo unidos a la molécula central. Los PBDEs existen en forma de mezclas de compuestos químicos similares. Debido a que sólo se mezclan con los plásticos y espumas en vez de unirse a ellos, pueden escapar de los productos que los contienen y entrar al medio ambiente. ¿Qué les sucede a los PBDEs cuando entran al medio ambiente? •Los PBDEs entran al aire, al agua y al suelo durante su manufactura y uso en productos de consumo. •En el aire, los PBDEs pueden encontrarse como partículas que eventualmente se depositan en el suelo o el agua. •La luz solar puede degradar algunos PBDEs. •Los PBDEs no se disuelven fácilmente en agua, pero se adhieren a partículas y se depositan en el fondo de ríos o lagos. •Algunos PBDEs pueden acumularse en peces, aunque generalmente en bajas concentraciones. ¿Cómo puede ocurrir la exposición a los PBDEs? •Las concentraciones de PBDEs en la sangre, leche materna y tejido graso de seres humanos indican que la mayoría de la gente está expuesta a concentraciones bajas de PBDEs. •Usted puede estar expuesto a los PBDEs a través del consumo de alimentos o inhalación de aire contaminados con PBDEs. •Los trabajadores que manufacturan PBDEs o productos que contienen PBDEs pueden estar expuestos a niveles más altos que lo normal. •También puede ocurrir exposición ocupacional en personas que trabajan en espacios cerrados en donde se reparan o reciclan productos que contienen PBDEs. . ¿Cómo pueden afectar mi salud los PBDEs? No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo. Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales. ¿Qué posibilidades hay de que los PBDEs produzcan cáncer? No sabemos si los PBDEs pueden producir cáncer en seres humanos. Las ratas y ratones que comieron de por vida alimentos con éter de decabromobifenilo (un tipo de PBDE) desarrollaron tumores en el hígado. Basado en esta evidencia, la EPA ha clasificado al éter de decabromobifenilo como posiblemente carcinogénico en seres humanos. La EPA ha determinado que los PBDEs con menos átomos de bromo que el éter de decabromobifenilo no son clasificables en cuanto a carcinogenicidad en seres humanos debido a la falta de estudios de cáncer en seres humanos y en animales. ¿Cómo pueden los PBDEs afectar a los niños? Los niños generalmente están expuestos a los PBDEs de la misma manera que los adultos, principalmente al comer alimentos contaminados. Debido a que los PBDEs se disuelven fácilmente en la grasa, pueden acumularse en la leche materna y puede ser transferidos a bebés que lactan. La exposición a los PBDEs en el útero y a través de la leche materna ha producido alteraciones de la tiroides y del comportamiento en animales recién nacidos, pero no ha producido defectos de nacimiento. No se sabe si los PBDEs pueden producir defectos de nacimiento en seres humanos. ¿Cómo pueden las familias reducir el riesgo de exposición a los PBDEs? •A los niños que viven cerca de sitios de desechos peligrosos se les debe aconsejar no jugar en la tierra cerca de estos sitios. También se les debe enseñar a no comer tierra y a lavarse las manos con frecuencia. •Las personas que están expuestas a los PBDEs en el trabajo deben ducharse y cambiar de ropa cada día antes de volver al hogar. La ropa de trabajo debe guardarse y lavarse en forma separada de la ropa del resto de la familia. Beneficios: Omega 3 ácido etil ésteres es el nombre dado a las grasas poliinsaturadas que son buenas para la salud. Estas grasas están obligadas a reducir los niveles de triglicéridos en el cuerpo, lo que controla los niveles de colesterol malo y prevención de enfermedades del corazón y paro cardíaco súbito. Hay numerosos otros beneficios del consumo de ésteres de omega 3 ácido etílico en forma de cápsulas. Estas cápsulas son fabricadas mediante el uso de aceite de pescado, que es una de las fuentes más ricas y más saludables, particularmente DHA y EPA. Los beneficios más notables del consumo de estos se observan en el contexto de la prevención de ciertas enfermedades como el cáncer y la enfermedad de Alzheimer. Además, también son buenos para la promoción de la salud general y salud mental particular. Ésteres de Omega 3 prevenir la depresión y la ansiedad y otros trastornos mentales relacionadas con la salud. Los médicos han reconocido los beneficios de salud asociados con el consumo de cápsulas de aceite de pescado. Recomiendan estos suplementos a personas de todas las edades, especialmente las mujeres embarazadas, niños y ancianos. Cápsulas son buenos para reducir la inflamación en todo el cuerpo. Dichas medidas pueden adoptarse en condiciones inflamatorias como artritis, cistitis y prostatitis. Normalmente de 3 a 4 porciones de un suplemento nutricional de omega 3 son recomendadas por los médicos. Sin embargo, si usted es deficiente, puede incrementar esta dosis. Suplementos de omega líquido también pueden añadirse a la dieta diaria para recibir una cantidad adecuada de DHA y EPA. 1 cucharada de aceite de pescado líquido es suficiente después de cada comida. Estos suplementos son excelentes para los niños y los ancianos ya que son muy fáciles de consumir y digerir. Algunas fuentes de alimentos que contienen ésteres de omega 3 ácido etílico son aceite de linaza, aceite de cáñamo, aceite de maíz, soya, frijoles, queso de soja, nueces y camarones. Huevos Omega 3 enriquecido también están disponibles ahora que proporcionan buenas cantidades de DHA y EPA. Usted debe también consumir pescado al menos dos veces a la semana para obtener su parte de los ácidos grasos saludables. Si usted está buscando en línea los suplementos, es aconsejable para encontrar los hechos con alto grado o aceite de calidad farmacéutica. Este aceite es refinado y purificada a través de un proceso conocido como destilación molecular y es apto para el consumo. Suplementos de Omega-3 no causan efectos secundarios, pero si tiene infecciones o alergias es aconsejable acudir al médico inmediatamente.
NOMBRE Y ESTRUCTURA DE LOS
COMPUESTOS MAS REPRESENTATIVOS
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos oinorgánicosoxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R'). Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.1 En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetiloes un éster, a veces llamado "éster dimetílico delácido sulfúrico".
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados: Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso éste reacciona con cloruro férrico produciendo un hidroxamato de intenso color rojo-violeta. En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes. En la formación de ésteres, cada radical OH (grupo hidroxilo) del radical del alcohol se sustituye por la cadena -COO del ácido graso. El H sobrante del grupo carboxilo, se combina con el OH sustituido, formando agua. En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico o inorgánico. Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.) Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación: Un éster cíclico es una lactona. 
Bibliografia:
http://espanol.answers.yahoo.com/question/index?qid=20100518192545AATmuo5 http://organica1.org/qo1/ok/eteres/eter1.htm http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-esteres/ http://www.galeon.com/cheko/aplica.html http://www.fiestasatope.com/numerosos-beneficios-de-los-esteres-etilicos-del-acido-omega-3.html https://www.dropbox.com/s/2sqstc753mus2x8/propiedad%20de%20los%20alcoholes.pdf http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_alcoholes.htm http://es.wikipedia.org/wiki/Alcohol#Propiedades_qu.C3.ADmicas_de_los_alcoholes | |||||||||||||||||||||||||||||||||||||||


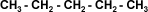
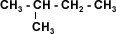
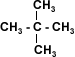
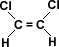
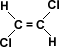
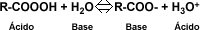
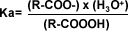
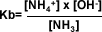







No hay comentarios:
Publicar un comentario